共同第一作者:赵大强
同济医院器官移植研究所副教授、副主任医师
肾移植是终末期肾病(ESRD)病人的最优治疗方式,可以显著提高病人生活质量和生存率。目前临床上预测肾移植结局主要依赖人类白细胞抗原(HLA)匹配程度,即评估供受者间能被T细胞、B细胞或NK细胞识别的抗原差异。这些差异已被证实与排斥反应、慢性移植肾病等密切相关。近年研究发现髓系先天免疫细胞(单核细胞/巨噬细胞/树突状细胞)也能直接识别供受者间的MHC或非MHC差异,并启动免疫反应。SIRPα是表达在髓系细胞表面的免疫调节受体,与CD47配体结合调节免疫稳态。已有研究发现小鼠中供受体SIRPα差异可激活宿主单核细胞从而引发慢性排斥和纤维化。人类SIRPα基因同样具有多态性特征,然而SIRPα不匹配对肾移植的影响目前尚不清楚。
2025年7月,来自美国匹兹堡大学医学院的Aravind Cherukuri团队和Fadi G. Lakkis团队在Science Translational Medicine杂志上发表题为“Donor-recipient mismatch at the SIRPA locus adversely affects kidney allograft outcomes”的文章,该研究发现当移植供受者SIRPα不匹配时,CD47与SIRPα的结合平衡被打破,先天髓系细胞激活,进而驱动排斥发生、早期纤维化和移植物功能丢失等不良反应。这一发现为肾移植提供了新的非HLA预后标志。

该论文入选为同期Sci Transl Med期刊网站置顶的三篇论文之一。华中科技大学同济医学院附属同济院器官移植研究所赵大强在其博士后期间开启了这项工作,是这项研究的共同第一作者。
首先,作者利用长期存活的小鼠肾移植模型比较了MHC与SIRPα均不匹配、仅 MHC不匹配和二者均不匹配但受者CD47缺失这三种情况。结果显示,SIRPα不匹配导致显著的慢性排斥病变、纤维化及免疫细胞浸润。而SIRPα匹配或受者CD47缺失则明显减轻这些改变,并伴随CD8 T细胞 IFN-γ 产生减少。表明SIRPα不匹配通过CD47介导单核细胞/巨噬细胞激活,从而驱动免疫介导的慢性移植物病变。(图1)
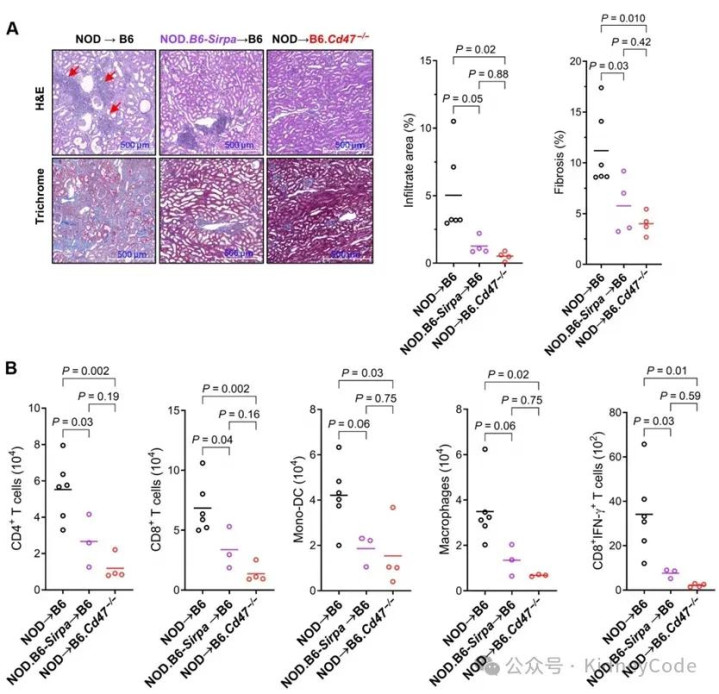
图1 SIRPα不匹配在小鼠肾移植中引发慢性移植物病变
接着,作者通过1000 Genomes数据,对5008例跨族群全基因组数据进行分析,首次绘制出人类SIRPA基因的高分辨率变异图谱,并根据CD47结合的两个关键氨基酸差异将SIRPα基因多态性差异简化为A(v1-like)与B(v2-like)两类功能等位基因。随后,为了探究人类SIRPα不匹配对肾移植病人的影响,作者对在匹兹堡大学医学中心(UPMC)接受肾移植的455例成人供受者进行了SIRPA基因分型。将SIRPA基因型划分为匹配、A→B及B→A三种组合后发现:B→A不匹配(供者B/受者A)使术后1年内迟发性急性排斥(发生在术后5-12个月)风险提高3倍,重度纤维化风险提高3.5倍,并伴随移植肾功能延迟恢复和持续炎症,预示远期移植物失功风险增高。而A→B不匹配仅与移植后第一年内早期排斥及间质纤维化(IFTA)相关,提示供体高亲和力B型SIRPα通过活化宿主单核细胞,引发持续炎症反应。(图2)
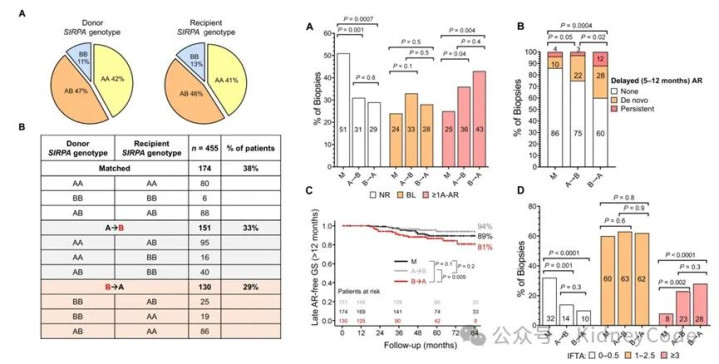
图2 SIRPA不匹配与人类肾移植急性排斥反应和纤维化相关
接下来作者对比了三组病人的7年总体移植物存活率,发现B→A不匹配使7年死亡删失存活率降至75%,总体存活率降至53%,风险显著高于A→B不匹配。另外,无论种族背景还是供受者亲缘度如何,SIRPA B→A不匹配均独立地与AR、IFTA和移植物丢失相关。在 UPMC 455例及西北大学258例活体肾移植两个独立队列中,B→A不匹配均使4年死亡删失存活率显著下降,综上证实其可作为跨人群的非HLA预后标志。(图3)
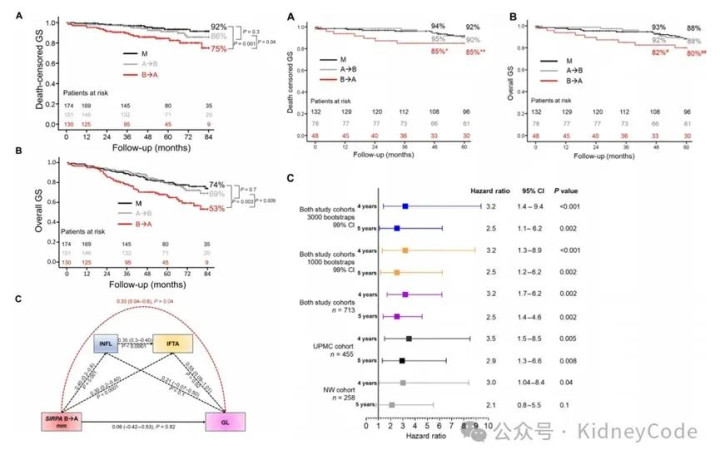
图3 SIRPA不匹配降低人类肾脏移植存活率
最后,作者进一步通过PBMC光谱流式分析发现SIRPA B→A不匹配术后3个月病人外周血单核细胞高表达 PD-L1、CCR2、CCR7、CD11c、CD74和CD163,呈现系统性活化表型,且该现象与是否发生急性排斥无关。另外同时间点活检显示,不匹配移植物内的 CD68⁺、CD163⁺、M2修复型巨噬细胞显著减少,表明局部抗炎-修复能力减弱。综上说明B→A 不匹配借助 CD47-SIRPα轴在外周与组织层面共同构建促炎、促纤维化微环境,为后续慢性移植物损伤和远期丢失奠定了生物学基础。(图4)
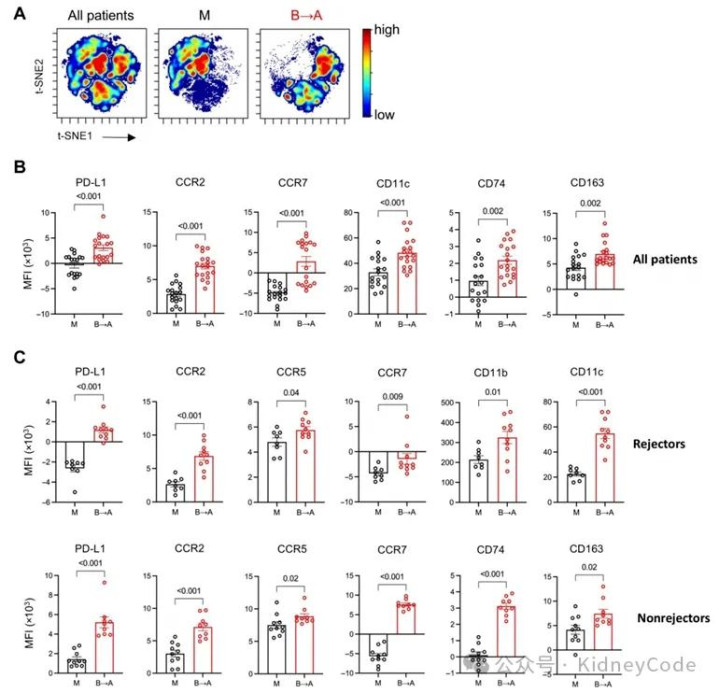
图4 SIRPA B→A不匹配与肾移植受者单核细胞活化表型相关


